Teori Asam Basa Lewis di Dalam ilmu Kimia
Sebelum membahas secara lebih detail tentang Teori Asam Basa Lewis yang diutarakan oleh Ahli Kimia Amerika Serikat, bernama Gilbert Newton Lewis (23 Oktober 1875 – 23 Maret 1946) maka ada baiknya bagi kalian para pembaca yang notabenya Pelajar, Mahasiswa ataupun Masyarakat Umum untuk mengetahui Pengertian Asam dan Basa itu sendiri.
Karena Pengertian Asam Menurut Ilmu Kimia memiliki artian sebuah Senyawa Kimia (Zat) yang dapat dilarutkan didalam Air dan akan menghasilkan Laruhan dengan pH yang lebih kecil dari 7 dan yang dapat memberikan Proton (ion H+) kepada Zat lain atau Senyawa Lain yang disebut dengan Basa. Sedangkan didalam Pengertian Basa menurut Ilmu Kimia adalah Zat (Senyawa Kimia) yang dapat beraksi dengan Asam, memberikan Senyawa yang disebut Garam dan Zat – Zat tersebut dapat menetralkan Asam.
Untuk Zat (Senyawa Kimia) Asam dan Basa ini saling berlawanan dan keduanya pun sering kita jumpai di kehidupan Manusia setiap harinya karena Zat (Senyawa Kimia) Asam ini ada didalam Cuka, Jeruk, Minuman Bersoda dan lain lain. Sedang Basa ada didalam Sabun, Bahan Pembuatan Pupuk dan lain lain. Oleh karena sangat baik sekali bagi kalian para Siswa Siswi untuk mengetahui secara lebih dalam tentang Zat (Senyawa Kimia) Asam dan Basa ini karena selain sering dijumpai di Kehidupan sehari – hari, Asam dan Basa tersebut pun sering muncul di Soal – Soal Ujian baik Ujian Sekolah atau Ujian Nasional di Mata Pelajaran Kimia.
3 Teori Asam dan Basa didalam Ilmu Kimia
Kemudian dikesempatan ini saya selaku penulis di Blog rumus rumus akan menjelaskan tentang salah satu Teori Asam dan Basa Menurut Lewis yang diutarakan di tahun 1932 silam oleh salah satu Ahli Kimia yang berasal dari Amerika Serikat, bernama Gilbert Newton Lewis karena sebelumnya saya telah menuliskan dan menjelaskan secara dalam tentang salah Teori Asam dan Basa yang lain yakni Teori Asam dan Basa Bronsted – Lowry dan tentunya telah ditulis dengan Sifat – Sifat Asam dan Basa nya.
Adapun perlu kalian tahu bahwa Teori Asam Basa dalam Ilmu Kimia telah terbagi menjadi 3 Teori Asam dan Basa yang antara lain Pertama Teori Asam Basa Arrhenius yang dikemukakan oleh Ahli Kimia Swedia bernama Svante August Arrhenius, Kedua Teori Asam Basa Bronsted Lowry yang dikemukakan oleh Dua Ahli Kimia yakni Jonannes Nicolaus Bronsted berasal dari Denmark dan Thomas Martin Lowry yang berasal dari Inggris serta yang ketiga ialah Teori Asam dan Basa Lewis yang dikemukakan oleh Ahli Kimia Asal Amerika Serikat yang bernama Gilbert Newton Lewis.
Bunyi Teori Asam Basa Lewis Secara Lengkap
Lalu didalam Teori Asam Basa menurut Lewis ini bahwa Asam merupakan suatu Senyawa Kimia (Zat) yang bisa menerima Pasangan Elektron dari Senyawa (Zat) lain atau bisa dikatakan Akseptor pasangan Elektron, sedangkan Basa Menurut Teori Asam Basa Lewis ialah suatu Senyawa Kimia (Zat) yang bisa memberikan pasangan Elektron kepada Senyawa yang lain atau bisa dikatakan sebagai Donor pasangan Elektron.
Teori Asam Basa Gilbert Newton Lewis ini merupakan sebuah Teori Asam Basa yang mengembangkan Teori Asam dan Basa Menurut Bronsted Lowry karena teori ini mempunyai keterbatasan dan kelemahan seperti saat menjelaskan reaksi – reaksi yang melibatkan senyawa tanpa proton (H+). Gilbert Newton Lewis berpendapat bahwa masalah Teori Asam-Basa harus diselesaikan dengan landasan Teori Struktur Atom, bukan hanya berdasarkan hasil percobaan (Penelitian) saja.
Contoh Teori Asam Basa Lewis Yang Ada
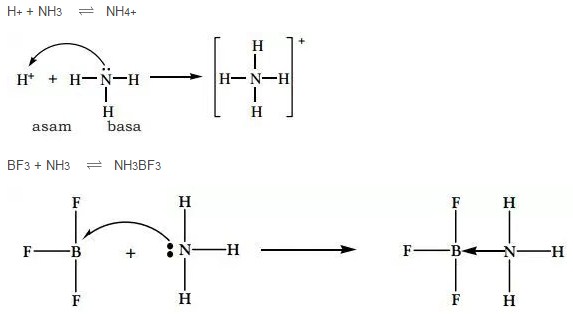
Contoh Teori Asam dan Basa Menurut Lewis pada Gambar diatas telah menunjukan bahwa Ion H+ (Proton) ialah Asam Lewis karena mampu menerima Pasangan Elektron, sedang NH3 merupakan Basa Lewis. Lalu pada reaksi antara BF3 dengan NH3 pada Gambar diatas yang merupakan Asam Lewis ialah BF3 karena bisa menerima sepasang Elektron dan teruntuk NH3 ialah Basa Lewis.
Untuk Kesimpulkan dari Perbedaan Teori Asam Basa Lewis dengan Bronsted Lowry adalah Teori Asam dan Basa Menurut Gilbert Newton Lewis lebih luas dan lengkap jika sepanjang yang dibahas didalamnya ialah Senyawa tanpa Proton, namun jika Reaksi Asam Basa yang melibatkan reaksi di Larutan dalam Air maka Teori Bronsted Lowrylah yang lebih mudah digunakan.
Rumus Cermin Datar, Sifat Cermin Datar Dan Contoh Soalnya
Rumus Cermin Datar | dalam kehidupan sehari-hari pasti kite menemukan berbagai cermin datar, bahkan dirumah anda juga pastinya memiliki cermin datar, jika anda sering melihat ibu atau mungkin kakak perempuan anda berdandan pastinya mereka menggunakan cermin datar untuk membantu melihat hasil dari kosemtiknya, dan mungkin ketika anda sedang potong rambut di barber atau salon, anda juga akan mendapati cermin datar yang lebar untuk bisa melihat hasil dari potonganan anda, jadi memang cermin datar ini sangatlah umum dan dibutuhkan dalam kehidupan masyarakat sekitar kita
Cermin datar itu memang memiliki bentuk yang datar tidak melengkung ataupun cembung , sehingga sifat (cermin datar) bayangan yang terbentuk pada cermin datar ini adalah maya, tegak dan sama besar dengan benda atau bayangan yang dipantulkan oleh cermin, berbeda dengan cermin cekung atau cembung yang akan memiliki hasil yang tidak sama besar dengan benda aslinya, maka dari itu cermin inilah yang paling sering ditemui, baik di rumah, supermarket ataupun tempat-tempat lainnya, jadi anda sudah paham betul bukan tentang cermin datar ini
Lalu bagaimana cara menghitung dan rumus cermin datar ?? tenang saja kami akan membahas lengkap disini mengenai rumus cermin datar, dan juga contoh soalnya agar anda bisa memahami mengenenai cermin datar ini, nah langsung saja anda bisa melihat rumus cermin datar dibawah ini
Rumus Cermin Datar
Dibawah ini adalah bayangan yang dibentuk oleh 2 buah cermin datar dengan sudut yang lancip
Apabila anda memiliki 2 buah cermin datar dan membentuk sudut lancip (θ) maka jumlah dari bayangan benda (n) yang dibentuk oleh 2 buah cermin datar itu bisa dicari menggunakan rumus :
Dan ketentuannya :
360/A = GANJIL, maka m = 0
360/A = GENAP, maka m = 1
Nah itulah rumus cermin datar, sekarang mari kita berlanjut ke contoh soal dari cermin datar agar anda lebih mengerti mengenai cermin ini dan anda bisa mengerjakan berbagai soal dari cermin datar baik di sekolah ataupun ketika anda menemukan pekerjaan rumah tentang cermin datar ini
Contoh Soal Cermin Datar
Jika bapak budi memiliki 2 buah cermin datar yang membentuk sudut 60º dan bapak budi meletakan pensil di muka cermin, maka berapakah bayangan pensil yang bisa terbentuk dari cermin datar itu ??
Jawab :
Contoh Soal 1
n= 360º/60º-1 ( M memiliki nilai 1 karena 360/60 itu memiliki hasil yang genap )
n= 6-1
n=5
Jadi jawaban dari soal diatas adalah, pensil memiliki 5 buah bayangan yang terbentuk dari cermin datar
Berlanjut ke contoh soal kedua mengenai cara mencari tinggi cermin datar karena memang kadang sering ditemui soal semacam ini, dan memang cara untuk menghitungnnya berbeda, nah rumus yang digunakan untuk mencari tinggi adalah
Tinggi cermin datar =1/2 x tinggi benda
Contoh soal 2
Tinggi Tegar adalah 158cm, berapakah tinggi cermin yang dibutuhkan agar tegar bisa melihat semua tubuhnya didalam cermin ???
Jawab :
Tinggi cermin Datar = 1/2×158= 79 Cm
Tinggi Cermin Datar = 79 cm
Nah itulah Rumus Cermin Datar yang bisa kami sampaikan untuk anda, cukup mudah bukan untuk menghitung cermin datar ini, pastinya anda harus menghafalkan rumusnya agar anda bisa mengerjakannya, jika anda tidak tahu rumusnya darimana anda bisa menjawab pertanyaan-pertanyaan diatas, jadi jangan malu untuk belajar dan menghafalkan rumusnya ya.. semoga bermanfaat
Teori Asam Basa Bronsted – Lowry Dalam ilmu Kimia
Teori Asam Basa Bronsted – Lowry | Pengertian Asam dan Basa ialah Dua Kata yang merupakan Senyawa Kimia dan mempunyai pengertian yang berbeda satu sama lain karena Pengertian Asam didalam ilmu Kimia ialah Senyawa Kimia yang jika dilarutkan didalam Air maka akan menghasilkan Larutan dengan pH yang lebih kecil dari 7. Senyawa Kimia Asam ini dapat memberikan Proton (Ion H+) kepada Zat lain yang disebut Basa atau bisa menerima Pasangan Elektrok Bebas dari Suatu Basa.
Sedangkan Pengertian Basa didalam ilmu Kimia adalah Senyawa Kimia yang mampu menyerap Ion Hidronium saat dilarutkan didalam Air dan Basa ini mempunyai pH yang lebih dari 7 (Kebalikan dari Asam). Contoh dari Asam sendiri antara lain Asam Asetat yang ada didalam Cuka dan Asam Sulfat yang ada didalam Baterai ataupun Aki Mobil, lalu Contoh dari Basa sendiri antara lain Basa Alumunium Hidroksida yang ada didalam Deodoran atau Antasida, Basa Natrium Hidroksida yang ada didalam Pembersih Saluran Pipa dan Basa Kalium Hidroksida yang ada didalam Sabun.
Adapun untuk Sifat – Sifat Asam dan Basa tentunya saling berbeda satu sama lain karena Sifat Asam antara lain tentunya mempunyai Rasa Asam, Larutan Asam dapat menghantarkan Arus Listrik, dapat mengubah Lakmus Warna Biru ke Lakmus Warna Merah, dapat menghasilkan Gas Hidrogen ketika beraksi dengan Logam, Asam dapat bereaksi dengan Basa yang membentuk Garam dan Air. Lalu Sifat – Sifat Basa sendiri antara lain memiliki Rasa Pahit, dapat mengubah Lakmus Warna Merah ke Warna Biru, Larutan Basa pun dapat menghantarkan Arus Listrik, berasa Licin dan Bersabun serta dapat beraksi dengan Asam dengan membentuk Garam dan Air.
Kemudian didalam Asam dan Basa Kimia ini terdapat 3 Teori Asam Basa terkenal yang masing – masing telah dikemukakan oleh Ahli Kimia dan Ilmuwan Kimia terkemuka di Dunia dan Ketiga Teori Asam dan Basa tersebut antara lain Teori Asam Basa Menurut Arrhenius, Teori Asam Basa Menurut Bronsted-Lowry dan Teori Asam Basa Menurut Lewis. Dari Ketiga Teori Asam Basa itu, yang akan pertama kali dibahas ialah Teori Asam dan Basa Bronsted – Lowry karena Teori ini yang paling mudah digunakan dari ketiga tersebut.
Bunyi Teori Asam Basa Bronsted – Lowry
Teori Asam Basa Bronsted – Lowry diajukan secara terpisah oleh Dua Ilmuwan Kimia di tahun 1923 yakni Ilmuwan Johannes Nicolaus Bronsted berasal dari Denmark yang hidup di tahun 1879 – 1947 dan Ilmuwan Thomas Martin Lowry berasal dari Inggris yang hidup di tahun 1874 – 1936. Konsep Dasar Teori Asam Basa Bronsted-Lowry ini ialah ketika suatu Asam dan Basa bereaksi antara satu sama lain, maka asam akan membentuk suatu Basa Konjugatnya dan Basa membentuk Asam Konjugatnya melalui pertukaran Proton.
Lalu untuk Bunyi Teori Asam Basa Bronsted – Lowry bahwa Asam merupakan senyawa yang bisa menyumbangkan Proton yakni Ion H+ ke Senyawa (Zat) yang lain dan Basa ialah Senyawa yang bisa menerima Proton yakni Ion H+ dari Senyawa (Zat) yang lain. Menurut Bronsted dan Lowry bahwa Zat bisa berperan dengan baik sebagai Asam maupun Basa, jika Zat itu lebih dulu melepas Proton karena Zat ini nantinya akan berperan sebagai Asam dan lawannya sebagai Basa.
Namun sebaliknya jika Suatu Zat lebih mudah menerima Proton, maka Zat tersebut akan berperan sebagai Basa dan dalam suatu Larutan Asam dalam Air, Air tersebut berperan sebagai Basa. Air merupakan Zat Atmosfer yang khas dan contoh reaksi Zat Atmosfer tersebut ialah reaksi antara 2 molekul Air yang dapat menghasilkan Ion Hidronium dan Ion Hidroksida.
Perbandingan Teori Asam Basa Bronsted Lowry dengan Teori Lewis
Teori Asam Basa Lewis berdasarkan pada Stuktur Elektron dan Sebuah Basa Lewis didefisinikan sebagai Suatu Senyawa yang bisa melepaskan Pasangan Elektron menjadi Asam dan Asam suatu Senyawa yang dapat menerima Pasangan Elektron. Gilbert Newton Lewis seorang Ilmuwan Amerika Serikat yang hidup pata tahun 1875 – 1946 ini telah membuat Teori Alternatif Reaksi Asam Basa dan Proposal Lewis ini telah memberikan penjelasan kepada Klasifikasi Teori Bronsted – Lowry dalam hal Struktur Elektron.
Namun yang jelas bahwa Teori Asam Basa Gilbert Newton Lewis ini yang paling luas dan yang paling tepat jika reaksi Asam – Basa itu melibatkan Senyawa tanpa Proton, tetapi jika yang dibahas tentang reaksi didalam Larutan Air, maka Teori Asam Basa Bronsted Lowry lah yang paling mudah digunakan karena Teori Bronsted – Lowry ini merupakan teori yang melengkapi dari kelemahan Teori Asam Basa Arrhenius yang digagas oleh Ilmuwan Kimia Svante August Arrhenius berasal dari Swedia.



0 Response to "√Teori Asam Basa Lewis Di Dalam Ilmu Kimia Lengkap Kuncinya"
Posting Komentar