Rumus Cermin Cekung Lengkap Dengan Contoh Soalnya
Rumus Cermin Cekung | setelah kita sebelumnya sudah membahas mengenai rumus cermin datar sekarang kita beralih ke pembahasan rumus cermin cekung, sebelum ke pembahasan mengenai rumusnya ada baiknya anda memahami pengertian cermin cekung, cermin cekung sendiri adalah cermin yang memiliki bentuk lengkung, dimana permukaan cermin cekung ini yang memantulkan cahaya yang melengkung ke belakang garis, garis normal di cermin cekung adalah garis yang melewati pusat dari kelengkungan di titik R atau 2F, sinar yang melewati titik tersebut akan dipantulkan kembali ke titik itu juga
Nah kemudian sifat bayangan yang dihasilkan dari cermin cekung ini juga tergantung dari letak bendanya jadi jika anda meletakan benda disamping kanan pastinya akan berbeda dengan benda yang diletakan di samping kiri ataupun diletakan persis ditengah-tengah dari cermin cekung itu, lalu bagaimana cara menentukan sifat bayangan itu ?? silahkan anda simak beberapa penjelasannya dibawah ini
Sifat Cermin Cekung
Jumlah dari ruang letak benda dan juga letak bayangan selalu = 5
Apabila ruang bayangan > ruang benda maka sifat dari bayangannya itu diperbesar
Apabila ruang bayangan < ruang benda maka sifat dari bayangannya itu diperkecil
Hanya bayangan yang ada di ruang 4 yang memiliki sifat maya dan juga tegak, dan selebihnya bersifat nyata dan juga terbalik
Sifat Bayangan jika jarak benda itu lebih kecil dibandingkan panjang fokus cermin cekung (s<f) :
Maya itu artinya bekas cahaya tidak melewati bayangan
Tidak terbalik atau tegak
Jika benda semakin jauh dari cermin cekung maka ukuran bayangannya akan semakin besar
Jika benda semakin jauh dari cermin cekung maka semakin jauh bayangan dari cermin cekung
Sifat-sifat bayangan jika benda terletak pada titik fokus cermin cekung (s=f)
Tegak atau tidak terbalik
Maya yang artinya berkas cahaya tidak melewati bayangan
Bayangan itu berada di jarak berhingga
Sifat-Sifat bayangan jika benda bedara di antara titik fokus dan juga titik pusat kelengkungan cermin cekung (f<s<R)
Terbalik
Nyata yang artinya berkas cahaya itu tidak melalui bayangan
Semakin jauh benda tersebut dari cermin cekung maka ukuran bayangan akan semakin mengecil
Semakin jauh benda tersebut dari cermin cekung maka semakin dekat bayangan dari carmin cekung
Sifat-sifat bayangan jika benda ada di titik pusat kelengkungan cermin cekung (s=R)
Sifat-sifat bayangan jika benda ada di titik pusat kelengkungan cermin cekung (s=R)
Terbalik
Ukuran benda sama dengan ukuran bayangan
Nyata yang artinya berkas cahaya melalui bayangan
Jarak benda sama dengan jarak bayangan
Sifat-sifat bayangan jika jarak benda lebih besar dibandingkan jari-jari kelengkungan cermin cekung (s>R)
Terbalik
Nyata yang artinya berkas cahaya melalui bayangan
Semakin jauh benda tersebut dari cermin cekung maka ukuran bayangan akan semakin mengecil
Semakin jauh benda tersebut dari cermin cekung maka akan semakin dekat bayangan dari cermin cekung
Sifat Cahaya Yang Dipantulkan Oleh Cermin Cekung
1. Sinar datang sejajar dengan sumbu utama, sinar itu akan dipantulkan melalui titik fokus
2. Sinar datang melalui titik lengkung (R) yang akan dipantulkan kembali ke arah yang sama
3. Sinar Datang melewati fokus, dan sinar itu akan dipantulkan sejajar dengan sumbu utama
Rumus Cermin Cekung
Kembali lagi ke pembahasan utama kita mengenai rumus cermin cekung, kami disini akan memberikan rumus cermin cekung dan contoh soalnya secara lengkap dan jelas agar anda bisa mengerti dan memahami mengenai cermin cekung yang sering kita temui di pelajaran sekolah atau di kehidupan sehari-hari, dibawah ini adalah rumus cermin cekung
Cermin cekung berfokus positif, apabila anda memiliki benda dengan jarak S dari cermin maka anda bisa mencari jarak bayangan dengan menggunakan rumus
Keterangan :
s adalah jarak benda dari cermin
s’ adalah jarak bayangan
f adalah fokus cermin
Sedangkan untuk mencari pembesaran bayangan anda bisa menggunakan rumus dibawah ini
Keterangan
s adalah jarak benda dari cermin
s’ adalah jarak bayangan
h’ adalah tinggi dari bayangan
h adalah tinggi benda
Contoh Soal Cermin Cekung
Setelah kita memberikan rumus cermin cekung sekarang mari kita coba praktekan rumus cermin cekung diatas untuk mengerjakan beberapa contoh kasus dibawah ini
1 buah penghapus setinggi 1 cm berada didepan cermin cekung dengan titik fokus 2cm , apabila penghapus berada di jarak 3 cm maka carilah , jarak bayangan (s’), pembesaran, tinggi bayangan (h’), sifat bayangan
Jarak bayangan
Diketahui :
f=2 cm
s=3 cm
Rumus : 1/f=1/s+1/s’
Jawab :
1/2 = 1/3 + 1/s’
1/s’ = 1/2-1/3
1/s’ = 3/6-2/6
1/s’ = 1/6
s’ = 6 cm
Pembesaran
Diketahui
s’= 6
s = 3
Rumus : M=S’/s
Jawab
M=6/3=2
Dua kali pembesaran
Tinggi Bayangan
Diketahui
M= 2
h = 1
Rumus : M=h’/h
Jawab
2=h’/1
h’=2cm
Sifat Bayanyan : terbalik, nyata, diperbesar
Nah itulah pembahasan lengkap mengenai rumus cermin cekung, semoga dapat bermanfaat dan membantu anda dalam memahami mengenai rumus cermin cekung ini , sebenarnya cermin cekung juga bisa ditemui dalam kehidupan sehari-hari dan sangatlah membantu sebagai pemantul pada lampu mobil, atau sebagai pemantul di senter dan lampu sorot, baca juga rumus cermin datar
Reaksi Asam Basa dan Reaksi Penetralan Dalam Kimia
Reaksi Asam Basa – Pengertian Reaksi Asam Basa (Reaksi Penetralan) didalam Ilmu Kimia adalah suatu Reaksi Kimia yang melibatkan Reagen (Zat atau Senyawa Kimia) Asam dan Reagen Basa yang dapat menghasilkan Garam dan Air. Reagen Asam yang dipakai dapat berupa Asam Lemah ataupun Asam Kuat, begitu pula dengan Reagen Basa yang dipakai bisa berupa Basa Lemah ataupun Basa Kuat.
Sebagai Contoh bila Asam Kuat direaksikan dg Basa Kuat maka akan menghasilkan suatu Garam Netral dengan pH sama dengan 7 dan jika Asam Kuat direaksikan dengan Basa Lemah maka akan menghasilkan suatu Garam dengan Sifat Asam. Namun jika Asam Lemah direaksikan dengan Basa Kuat maka akan menghasilkan Garam dengan Sifat Basa, apabila Asam Lemah direaksikan dengan Basa Lemah maka akan menghasilkan suatu Garam dengan Sifat tergantung kepada Nilai ka ataupun kb didalamnya.
Sedangkan untuk Macam – Macam Reaksi Asam Basa yang sering muncul di Kurikulum Pelajaran Kimia yang harus kalian tahu dan pahami sebagai Pelajar, Mahasiswa maupun Masyarakat Umum antara lain Reaksi Antara Asam dengan Basa, Reaksi Antara Oksida Asam dengan Basa, Reaksi Antara Asam dengan Oksida Basa, Reaksi Antara Asam dengan Amonia dan Reaksi Antara Oksida Asam dengan Oksida Basa.
Untuk itu di kesempatan kali ini saya selaku penulis Website Rumus Rumus akan menuliskan dan menjelaskan kepada kalian para Pembaca tentang Macam – Macam Reaksi Asam dan Basa tersebut secara lebih detail karena pada kesempatan sebelumnya saya selaku penulis telah menjelaskan dan menuliskan secara lebih lengkap tentang Sifat dan Teori Asam Basa didalam ilmu Kimia, yang tentunya bisa kalian baca dan pahami di Laman Website Rumus Rumus ini.
1. Reaksi Asam Basa Antara Asam dengan Basa
Didalam Larutan Netralisasi akan terjadi peristiwa antara Asam Kuat dengan Basa Kuat yang mampu menghasilkan persamaan Reaksi Ion dan Persamaan Molekuler dari Reaksi Penetralan (Reaksi Asam dan Basa) Antara Basa Asam dengan Basa tersebut pada umumnya akan menghasilkan Air dan Garam.
ASAM + BASA → GARAM + AIR
Contoh Reaksi Asam dan Basa Antara Asam dengan Basa seperti ini, jika suatu Reaksi antara Larutan Asam Klorida dengan Larutan Natrium Hidroksida maka akan menghasilkan Larutan Garam Natrium Klorida dan Air.
Contoh Soal Reaksi Asam dan Basa Antara Asam dengan Basa dengan pertanyaan seperti ini, ” Tuliskan Persamaan dari Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih untuk Reaksi Asam dan Basa Larutan Asam Nitrat yang ditambahkan dengan Larutan Kalium Hidroksida.
2. Reaksi Antara Oksida Asam dengan Basa
Pengertian Oksida Asam didalam Ilmu Kimia ialah Oksida Non Logam yang saat dilarutkan ke dlm Air maka akan membentuk Asam dan melepaskan Ion H+. Reaksi Antara Oksida Asam dengan Basa ini akan membentuk Garam dan Air.
OKSIDA ASAM + BASA → GARAM + AIR
Contoh Soal Reaksi Asam Basa Antara Oksida Asam dengan Basa dengan pertanyaan : Reaksi antara Gas Karbon Dioksida dengan Larutan Natrium Hidroksida (CO2 + NaOH).
3. Reaksi Antara Asam dengan Oksida Basa
Pengertian Oksida Basa didalam ilmu Kimia ialah suatu Oksida Logam yang saat dilarutkan didalam Air maka akan membentuk Basa dan akan melepaskan Ion H-. Reaksi Antara Asam dengan Oksida Basa tersebut akan membentuk Suatu Garam dan Air seperti dibawah ini :
ASAM + OKSIDA BASA → GARAM + AIR
Contoh Soal Reaksi Antara Asam dengan Oksida Basa dengan Soal seperti : carilah Persamaan Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih jika Reaksi Antara Asam Bromida dengan Natrium Oksida.
4. Reaksi Asam Basa Antara Asam dengan Amonia
Pengertian Amonia didalam ilmu Kimia ialah Basa Lemah yang saat dilarutkan didalam Air maka terbentuk NH4OH dan Reaksi Antara Asam dengan Amonia ini akan menghasilkan Garam Amonium dengan Reaksi seperti dibawah ini :
ASAM + NH3 → GARAM AMONIUM
Contoh Reaksi Asam Basa Antara Asam dengan Amonia jika Soalnya seperti ini : carilah Persamaan Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih jika Reaksi Antara Asam Klorida dengan Amnonia (HCI + NH3).
5. Reaksi Antara Oksida Asam dengan Oksida Basa
Jika Reaksi Antara Oksida Asam dengan Oksida basa maka akan terbentuk Garam dengan Reaksi seperti dibawah ini :
OKSIDA ASAM + OKSIDA BASA → GARAM
Contoh Soal Reaksi Antara Oksida Asam dengan Oksida Basa jika Soalnya seperti berikut ini : tuliskan Persamaan Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih jika Reaksi Kalsium Oksida padat direaksikan dengan Gas Belerang Oksida.
Itulah pembahasan tentang Pengertian dan Macam Reaksi Asam Basa didalam ilmu Kimia dan semoga saja apa yang sudah dijelaskan atau dituliskan di artikel ini dapat berguna dan bermanfaat bagi kalian para pembaca yang notabenya para Pelajar baik itu Tingkat Sekolah Menengah Pertama (SMP) maupun Sekolah Menengah Atas (SMA) dan Masyarakat Umum yang ingin lebih mengenal tentang Reaksi Asam dan Basa.
Bunyi Teori Asam Basa Arrhenius Dalam ilmu Kimia
Teori Asam Basa Arrhenius – Sebelum membahas terlebih jauh tentang Teori Asam dan Basa Menurut Arrhenius, ada baiknya bagi kalian para pembaca di Blog Rumus Rumus untuk mengetahui atau mengerti apa itu Asam dan Basa karena Pengertian Asam dalam Ilmu Kimia adalah Suatu Zat (Senyawa Kimia) yang dapat memberikan Ion H+ (Proton) kepada Zat (Senyawa Kimia) lain, sedang Pengertian Basa dalam Ilmu Kimia ialah Senyawa Kimia yang dapat menyerap Ion Hidronium ketika dilarutkan didalam Air dan secara Kimia antara Asam dan Basa itu saling berlawanan.
Adapun didalam Sifat Asam dalam ilmu Kimia antara lain mempunyai rasa Asam atau Masam, mampu merusak (Korosif), saat dilarutkan didalam Air maka bisa menghasilkan Ion H+ atau Ion – Ion Hidrogen dan Ion Sisa Asam yg bermuatan Negatif dan saat diuji didalam Indikator Keras Lakmus Biru maka dapat merubah Lakmus Biru itu menjadi warna merah, Indikator itu merupakan suatu alat yang dapat menunjukan suatu Zat (Senyawa) apakah bersifat Asam ataupun Basa.
Sedangkan Sifat – Sifat Basa didalam ilmu Kimia antara lain mempunyai Rasa Pahit, Bersifat Kaustik atau merusak kulit, Saat dilarutkan didalam Air maka dapat menghasilkan Ion OH- atau Ion Hidroksil dan Ion Logam yang mempunyai muatan Negatif, lalu saat diuji didalam Indikator berupa Lakmus berwarna Merah maka akan mengubah Lakmus Warna Merah tersebut menjadi Lakmus Warna Biru, namun jika diuji dengan Lakmus Warna Biru maka tidak akan mengubah Warna Kertas Lakmus tersebut.
Kemudian perlu kalian ketahui bahwa didalam ilmu Kimia terdapat Tiga Macam Teori Asam Basa yang antara lain Teori Asam Basa Menurut Arrhenius, Teori Asam Basa Menurut Bronsted – Lowry dan Teori Asam Basa Menurut Lewis. Untuk Kedua Teori Asam Basa Menurut Bronsted – Lowry dan Menurut Lewis sudah saya jelaskan di dalam Blog Rumus Rumus, oleh karena itu dikesempatan ini saya akan menjelaskan secara lebih detail tentang Teori Asam Basa Arrhenius ini kepada kalian para pembaca baik para Siswa Siswi, Mahasiswa maupun Masyarakat Umum yang ingin mengenal tentang Teori Asam dan Basa Arrhenius.
Bunyi Teori Asam Basa Arrhenius Dalam Kimia
Teori Asam Basa Arrhenius merupakan salah satu Teori Asam Basa yang paling tua dari Teori Asam Basa yang lain karena teori ini dicetuskan di tahun 1884 silam oleh seorang Ilmuwan Kimia berasal dari Swedia yang bernama Svante August Arrhenius yang lahir pada 19 Februari 1859 dan meninggal pada 2 Oktober 1927. Pada tahun 1884 Silam Svante August Arrhenius mengusulkan tentang Klasifikasi Senyawa – Senyawa yang dinamakan Asam dan Basa, seperti yang telah dijelaskan oleh Arrhenius bahwa Reaksi Asam Basa ditandai oleh Asam yg telah berdisosiasi pada larutan yang berair membentuk Ion Hidronium dan Basa membentuk Ion Hidroksida.
Menurut Teori Asam Basa Arrhenius bahwa Asam ialah Zat yang jika didalam Air dapat melepaskan Ion Hidrogen (H+), Ion – Ion Hidrogen yang dihasilkan oleh Asam tersebut ketika dilarutkan di dlm Air terikat pada Molekul – Molekul Air (H2O) dlm bentuk Ion Hidronium adalah Ion yang Positif yg dibentuk oleh sebuah Proton (Ion Hidrogen) pada sebuah Molekul Air. Didalam Teori Asam dan Basa Arrhenius, Asam terdiri dari Dua Macam yakni Asam Kuat dan Asam Basah jika diukur dari Kekuatan dan besarnya derajat Ionisasi didalam Larutan Air.
Asam Kuat dalam Teori Asam Basa Arrhenius ialah Asam yang mempunyai Derajat Ionisasi mendekati Satu Asam yang mengalami Ionisasi sempurna dan Contoh dari Asam Kuat antara lain Asam Klorida (HCI), Asam Bromida (HBr), Asam Iodida (HI), Asam Nitrat (HNO3), Asam Sulfit (H2SO3), Asam Fostat (H3PO4) dan Asam Karbonat (H2CO3).
Sedangkan Asam Lemah menurut Teori Asam Basa Svante August Arrhenius adalah Asam yg mempunyai Derajat Ionisasi lebih kecil atau asam yg mengalami Ionisasi sebagian dan Contoh dari Asam Lemah ini antara lain Asam Fluorida (HF), Asam Asetat (CH3COOH), Asam Sianida (HCN), Asam Nitrit (HNO2), Asam Sulfit (H2SO3) dan Asam Fostat (H3PO4).
Lalu Basa Menurut Teori Asam Basa Arrhenius adalah Senyawa atau Zat yang didalam Air dapat menghasilkan suatu Ion Hidroksida (OH-) dan Basa berdasarkan Ion OH- yang dilepaskan pd reaksi Ionisasi basa dibedakan menjadi Basa Monohidroksi yang mempunyai pengertian suatu Basa yang bereaksi pada Ionisasi melepaskan Satu Ion OH-.
Adapun untuk Kelemahan Teori Asam dan Basa Arrhenius ialah tidak semua senyawa bersifat Asam ataupun Basa dapat menghasilkan Ion H+ atau OH- jika dilarutkan didalam Air. Oleh karena itu dengan melihat Kelemahan Teori Asam Basa Arrhenius maka seorang Ilmuwan yang bernama Bronsted dan Ilmuwan Lowry menggagas Teori Asam Basa lain, yang sering dikenal sebagai Teori Asam Basa Bronsted – Lowry untuk menguatkan Teori Asam Basa Menurut Arrhenius yang sudah ada.
Kesimpulannya dari Ketiga Teori Asam dan Basa yang ada didalam Ilmu Kimia adalah Teori Asam Basa Oleh Arrhenius merupakan Teori Asam Basa yang paling terbatas, sedangkan jika dilihat dari Reaksi di Larutkan dalam Air maka Teori Asam Basa Bronsted-Lowry lah yang paling mudah digunakan, namun jika dilihat dari Reaksi Asam Basa yang melibatkan Senyawa tanpa Proton maka Teori Asam dan Basa Lewislah yang paling tepat dan yang paling luas.


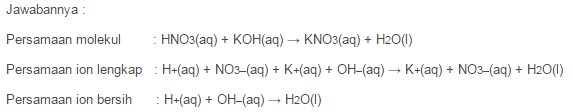
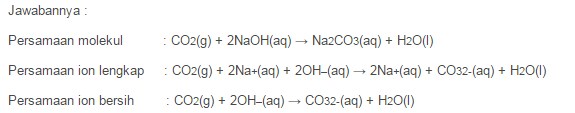
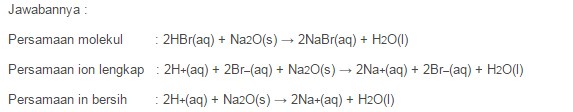



0 Response to "√Rumus Cermin Cekung Lengkap Dengan Contoh Soalnya Lengkap Kuncinya"
Posting Komentar